Op zoek naar nieuwe anti-epileptica
Bepaalde moleculen, tRNAs, of fragmenten daarvan, tRFs, lijken in de hersenen een rol te spelen bij het ontstaan van temporaalkwabepilepsie (TLE). Met een subsidie van het epilepsiefonds gaat Jeroen Pasterkamp van het UMC Utrecht hier onderzoek naar doen. “Als we ze op de juiste manier kunnen manipuleren, biedt dat aanknopingspunten voor een nieuwe generatie anti-epileptica.”
Epilepsie is een ernstige chronische aandoening van het zenuwstelsel die wereldwijd 60 miljoen mensen treft. De aandoening uit zich in de vorm van aanvallen, die ontstaan door een plotselinge verstoring van de elektrische prikkeloverdracht in de hersenen. Afhankelijk van de plek waar dit gebeurt, kunnen patiënten bijvoorbeeld vallen, schokkende bewegingen maken, iets vreemds ruiken, even afwezig zijn of buiten bewustzijn raken. De onvoorspelbaarheid van deze aanvallen beperkt de bewegingsvrijheid van epilepsiepatiënten en heeft een grote impact op hun veiligheid en sociaal welbevinden. Bovendien kan voortdurende epileptische activiteit leiden tot schade aan de hersenen en het verlies van verstandelijke vermogens. Volgens het Epilepsiefonds krijgen in Nederland jaarlijks zo’n 14.000 mensen de diagnose epilepsie.
Temporaalkwabepilepsie
Temporaalkwabepilepsie, afgekort tot TLE (temporal lobe epilepsy), is één van de meest voorkomende en ernstigste vormen van epilepsie. Hierbij is een hersengebied aangedaan, dat betrokken is bij het leren en het geheugen (hippocampus). Bijna een derde van de TLE-patiënten houdt ernstige aanvallen ondanks een behandeling met verschillende medicijnen. Voor deze patiënten is de chirurgische verwijdering van de hippocampus vaak het enige redmiddel, zij het dat niet alle TLE-patiënten hiervoor in aanmerking komen en de ingreep niet zonder risico en niet altijd effectief is.
Hersenweefsel
Voor de ontwikkeling van nieuwe therapieën, die fundamenteel anders werken dan de bestaande anti-epileptica (en die ook verder gaan dan symptoombestrijding), is meer kennis nodig over het ontstaan van epilepsie. Jeroen Pasterkamp, hoogleraar translationele neurowetenschappen, doet hier onderzoek naar en hij houdt zich al bijna tien jaar bezig met temporaalkwabepilepsie. Hij bestudeert daarbij onder meer het hersenweefsel van TLE-patiënten, waarbij de epileptische haard door de neurochirurg is verwijderd. “Dat materiaal halen wij direct op uit de operatiekamer”, vertelt hij, “uiteraard met toestemming van de patiënt. Door eerdere studies weten we dat er veranderingen in de hersenen van TLE-patiënten optreden, lang voordat de eerste aanval begint. Er zijn onverklaarbare verschillen in de hoeveelheid eiwitten, maar hoe die ontstaan, is onbekend.”
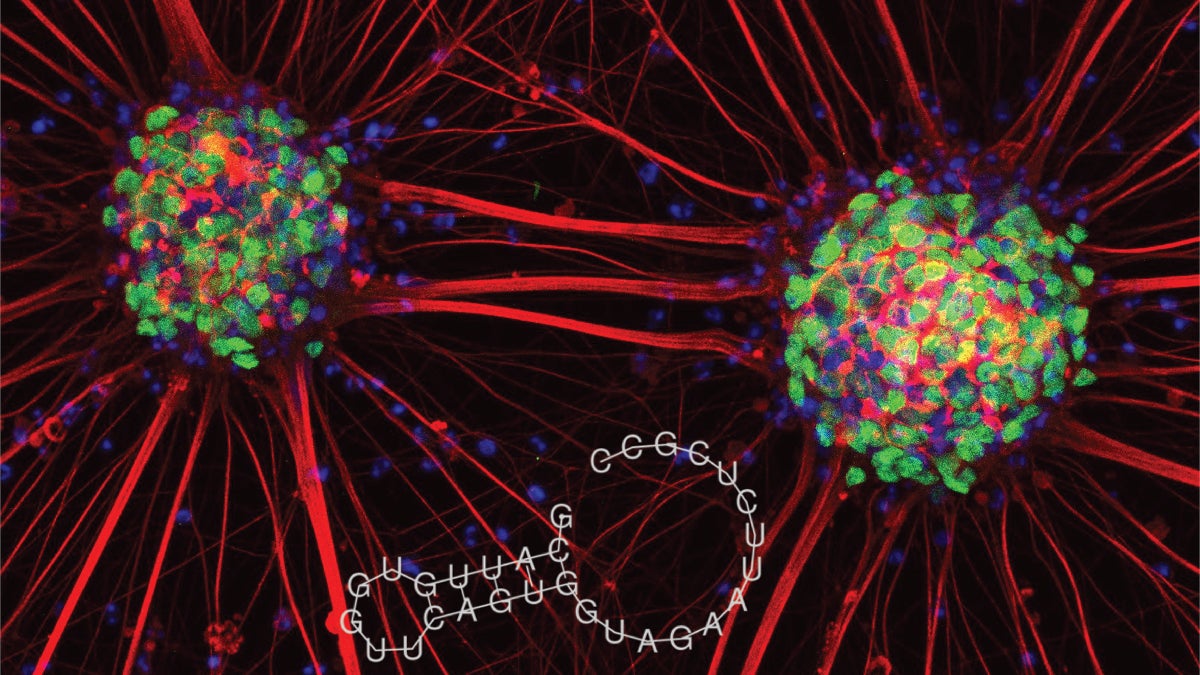
transferRNAs
Met een subsidie van het Epilepsiefonds gaat Jeroen nu de komende drie jaar de rol van zogeheten transferRNAs (tRNAs) onderzoeken. Dat zijn moleculen in de hersenen, waarvan hij verwacht dat ze ten grondslag liggen aan temporaalkwabepilepsie. tRNAs zijn RNAs die niet coderen voor een eiwit maar die wel een belangrijke rol spelen in de eiwitsynthese, het proces waarbij eiwitten gemaakt worden met informatie uit het DNA. Jeroen: “tRNAs brengen aminozuren naar de juiste plaats om eiwitten aan te maken en ze spelen een rol bij de regulering van de hoeveelheid eiwitten. Opmerkelijk is dat deze grote moleculen uiteen kunnen vallen in fragmenten. We noemen die fragmenten tRFs (zie foto). Wat die tRFs doen, is nog onduidelijk, maar het is geen afval. Het zijn bio-actieve moleculen met een nieuwe, nog onbekende functie.”
RNA-sequencing
Eerder onderzoek van Jeroen naar microRNAs (waartoe ook de tRFs behoren) in muizen liet zien dat, als je die uitschakelt, de epileptische aanvallen bij hen volledig verdwijnen. “Nu is het bij traditioneel muizenonderzoek zo dat je ze een aanval geeft en direct erna behandelt”, licht hij toe. “Dat is dus niet helemaal vergelijkbaar met mensen: die worden pas later na een aanval behandeld. Maar als we bij muizen met de behandeling even lang wachten als bij mensen, blijkt het ook te werken.” Recent ontdekte hij ook dat tRNAs in de hersenen van TLE-patiënten afwijkingen vertonen, maar hoe dat precies in elkaar steekt is nog onduidelijk.
Als eerste stap gaat Jeroen nu met behulp van RNA-sequencing onderzoeken welke tRNAs/tRFs afwijkend zijn in het hersenweefsel van TLE-patiënten en in welk type zenuwcel deze tRNAs/tRFs voorkomen. Vervolgens zal hij een aantal specifieke tRFs in humane zenuwcelkweken manipuleren om te bepalen hoe ze precies werken en waarom ze afwijken bij TLE. Ten slotte zal hij nagaan of manipulatie van deze specifieke tRFs kan leiden tot een vermindering van epileptische activiteit.
Therapeutische targets
Jeroen: “Ik ben reuze benieuwd hoe die tRFs ontstaan. En als we de afwijkende tRNAs hebben kunnen detecteren, ben ik benieuwd hoe ze werken en welke processen verstoord raken als je ze manipuleert. En welke gevolgen dat heeft voor epilepsiepatiënten: is er sprake van defecten in de synapscommunicatie, van een overactief brein of juist niet?” Hij verwacht dat het onderzoek de eerste directe aanwijzing zal leveren dat tRFs te maken hebben met de epileptische activiteit in zenuwnetwerken van patiënten met TLE. En dat het de nodige tools zal opleveren om tRNAs en tRFs te manipuleren. En dat het daarmee een belangrijk startpunt vormt voor het vinden van een nieuwe, meer effectieve behandeling van TLE. “We zien niet-coderende RNAs, waaronder dus de tRNAs, als dé therapeutische targets van de toekomst in de behandeling van hersenziekten.”